O que é o colangiocarcinoma intra-hepático (iCCA)?
O iCCA é um subtipo de colangiocarcinoma (CCA)
O CCA, o carcinoma primário mais frequente dos ductos biliares, classifica-se segundo a sua origem anatómica em CCA intra-hepático (iCCA) e CCA extra-hepático (eCCA). O eCCA subdivide-se ainda em 2 tipos:1-3
- O CCA peri-hilar (pCCA) (também designado “tumor de Klatskin”) é a forma mais comum, e representa 50–70% de todos os casos de CCA1,3
- O CCA distal (dCCA) representa 30–40% do total de casos de CCA1,3
O iCCA tem origem nos ductos biliares dentro do fígado e corresponde a <10% dos casos de CCA1,3
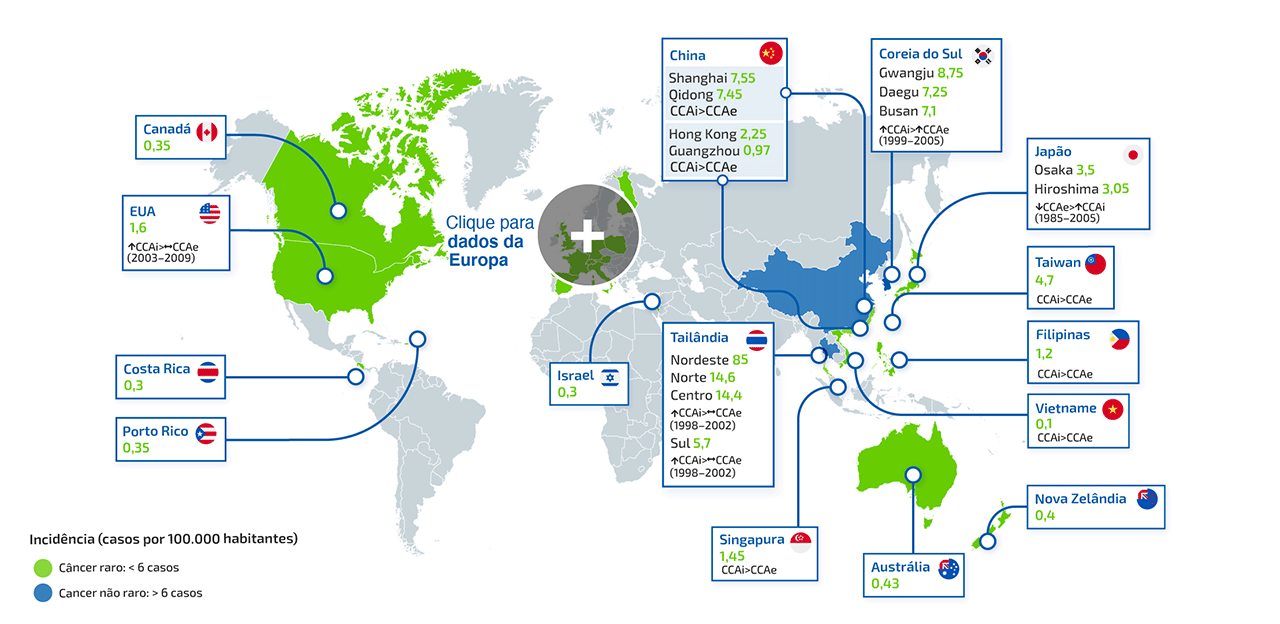
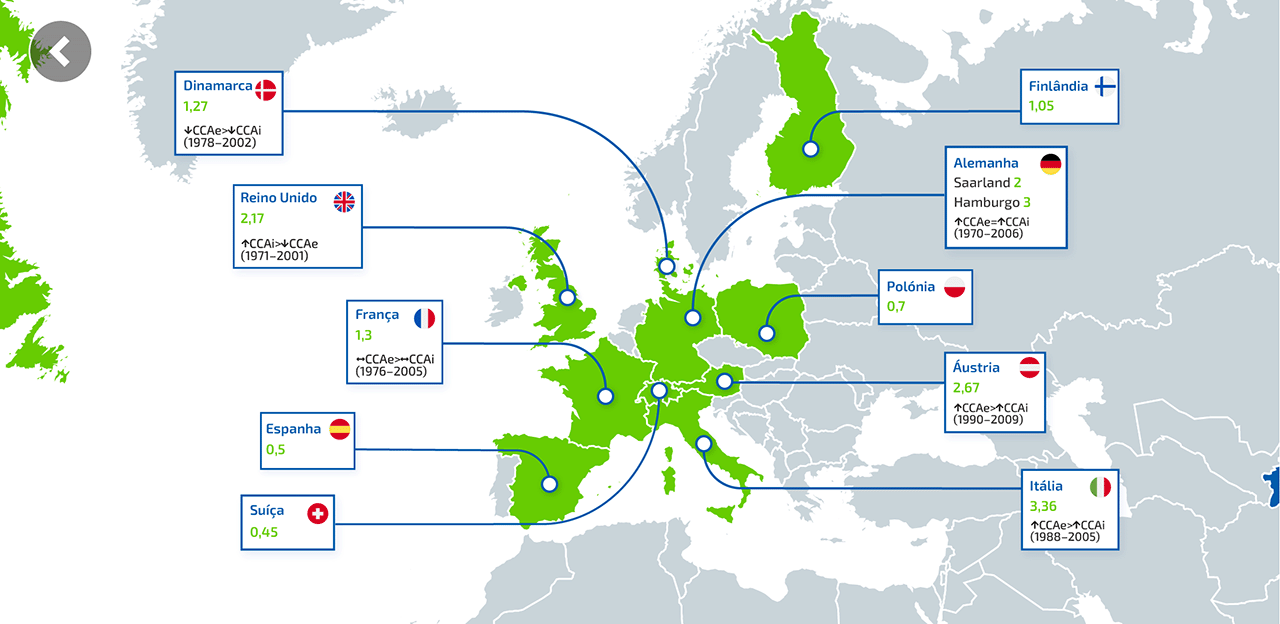
O CCA classifica-se segundo a sua origem anatómica3,4
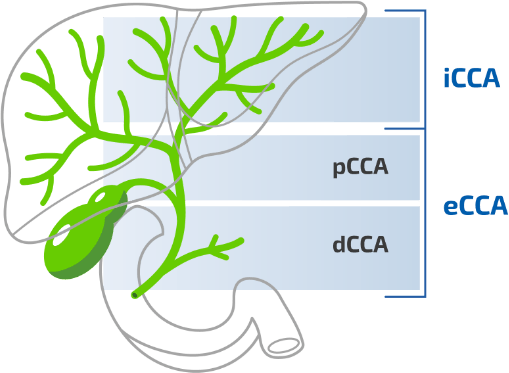
CCA: colangiocarcinoma; dCCA: colangiocarcinoma distal; eCCA: colangiocarcinoma extra-hepático; iCCA: colangiocarcinoma intra-hepático; pCCA: colangiocarcinoma peri-hilar.
Figura adaptada de Blechacz B. 2017.4